酸性雨について
酸性雨とは
どうして雨が酸性に?
石油・石炭などの燃焼によって大気中に放出される排ガスの中には、硫黄酸化物(SO2)や窒素酸化物(NOx)などの大気汚染物質が含まれています。これらは大気中で紫外線によって、硫酸や硝酸などの酸性物質となり、雲(水蒸気)に取り込まれ、酸性の雨となります。(図1)
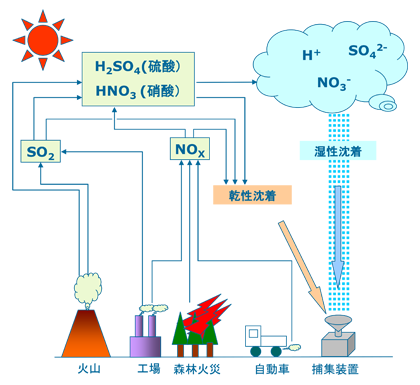
図1. 大気中での酸の生成と沈着
酸性雨問題の発端
19世紀のイギリスでは、産業革命の進展により大量の石炭やコークスが消費されるようになりました。そのため、排ガスの影響によって、すでに降水が酸性化していたことが分かっています。
1960年代になって、スウェーデンの科学者オーデンは、スカンジナビア地域の降水が酸性化し、環境に悪影響を及ぼしていること、その原因がイギリスやヨーロッパ各地で排出された大気汚染物質であることを示し、酸性雨が広域的な環境問題であることを明らかにしました。
日本では1973〜75年に関東地方に酸性度の強い雨が降り、多くの人に目の痛みなどの健康被害が発生しました。このころから酸性雨問題が表面化し、多くの自治体で酸性雨の観測が始まりました。
酸性雨による影響とは?
量の少ない降水に多くの酸が取り込まれると高濃度の酸になり、過去には霧雨などによる住民の健康影響が懸念されました。また、濃度が低くても多くの酸が地表に降り注ぐと大きな影響を与える場合があり、北欧などで報告されているように河川や湖沼、土壌などの酸性化による生態系への被害が懸念されるところです。
日本では生態系への明らかな酸性雨の被害はまだ報告されていませんが、伊自良湖(岐阜県)の流入河川、中部山岳地帯の河川などでの酸性化が報告されており、酸性雨の影響について検討がすすめられているところです。そのため、引き続き観測を行なっていくことが大変重要となっています。
現在の酸性雨調査
溶けているイオンが問題
pHは、降水の中の水素イオン濃度(H+)を示す指標であり、低いほどH+濃度が高くなり、pHが1違うとH+濃度が10倍違うこととなります。H+濃度は、取り込まれた酸性物質と塩基性物質(農業活動由来のアンモニアや土壌粒子由来のCaCO3など)で決まります。取り込まれた物質はイオン成分になり、この陰イオンと陽イオンのバランスでH+濃度が決ります。そのため、酸性物質を大変多く取り込んでいても塩基性物質も多く取り込んだpH5の水があるかと思えば、塩基性物質がほとんど取り込まれず、酸性物質の量に直接相当するpH3の水もあります。したがって酸性物質のみならず、塩基性物質も重要となります。また発生源の寄与を調べるには、pHだけでなく、降水の中に含まれているイオンの種類と量を知る必要があります。
現在、国や多くの地方公共団体が実施している酸性雨の調査では、pHだけでなく硫酸イオン、硝酸イオンをはじめとした多くの汚染物質を測定しています。(図2)
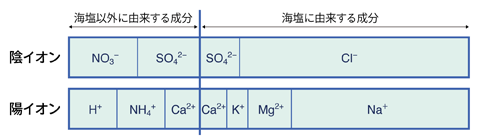
図2. 降水のイオン組成(仮想)
日本は海に囲まれているため海塩成分(太線の右側)の割合が高くなっています。SO
42−とCa2+は海塩とそれ以外の発生源の両方を持つため、Na+を基準としてそれぞれの割合を計算し、非海塩分にはnss-を付けて表すのが一般的です
湿性沈着と乾性沈着
たとえば年間に100日雨が降るとします。湖や周辺の山に降った雨が川などを経て湖に流れ込み、一定期間滞留した後、河川を通じて流れ出てゆきます。このとき、雨によって、湖に新たに入り込む汚染物質(酸性物質や塩基性物質)の量は、1年間にどれだけの雨が降り、その中にトータルでどれくらいの汚染物質が含まれているかを調べることで把握できるはずです。しかし、年間265日の雨が降らないときは何が起こっているのでしょう。雨の中の汚染物質は、もともと空気中の汚染物質が雲や雨粒に溶け込んでできたものですから、雨雲のない時でも汚染物質は空中を漂っているはずですし、一定量は地上に落ちてきていることが予想されます。
こうした雨によらずに地上にもたらされる現象を「乾性沈着」と言います。一方で降水などによって地上にもたらされる場合を「湿性沈着」と言います(図1参照)。この乾性沈着を調べてみると、地域にもよりますが、驚いたことに湿性沈着と同じ程度の汚染物質が、微小な粒子やガスとして地上にもたらされていることがあると分かってきました。



